當(dāng)前位置:首頁(yè) >> 探索 > 食药监总局发布WhatsApp%E3%80%90+86%2015855158769%E3%80%91crawl%20crane《医疗器械召回管理办法》
- 国家食品药品监督管理总局令
- 第29號(hào)
- 《医疗器械召回管理办法》已于2017年1月5日經(jīng)國(guó)家食品藥品監(jiān)督管理總局局務(wù)會(huì)議審議通過(guò),食藥現(xiàn)予公布,監(jiān)總局自2017年5月1日起施行。布醫(yī)WhatsApp%E3%80%90+86%2015855158769%E3%80%91crawl%20crane
- 局長(zhǎng):畢井泉
- 2017年1月25日
- 医疗器械召回管理办法
- 第一章 总 则
- 第一条 为加强医疗器械监督管理,疗器理办控制存在缺陷的械召医疗器械产品,消除医疗器械安全隐患,回管保证医疗器械的食药安全、有效,监总局保障人体健康和生命安全,布医根据《医疗器械监督管理条例》,疗器理办制定本办法。械召
- 第二条 中华人民共和国境内已上市医疗器械的回管召回及其监督管理,适用本办法。食药
- 第三条 本办法所称医疗器械召回,监总局是布医指医疗器械生产企业按照规定的程序对其已上市销售的某一类别、型号或者批次的存在缺陷的医疗器械产品,采取警示、检查、修理、重新标签、修改并完善说明书、软件更新、替换、收回、销毁等方式进行处理的行为。
- 前款所述醫(yī)療器械生產(chǎn)企業(yè),是指境內(nèi)醫(yī)療器械產(chǎn)品注冊(cè)人或者備案人、進(jìn)口醫(yī)療器械的境外制造廠商在中國(guó)境內(nèi)指定的代理人。
- 第四条 本办法所称存在缺陷的医疗器械产品包括:
- (一)正常使用情況下存在可能危及人體健康和生命安全的不合理風(fēng)險(xiǎn)的产品;
- (二)不符合強(qiáng)制性標(biāo)準(zhǔn)、經(jīng)注冊(cè)或者備案的產(chǎn)品技術(shù)要求的产品;
- (三)不符合醫(yī)療器械生產(chǎn)、經(jīng)營(yíng)質(zhì)量管理有關(guān)規(guī)定導(dǎo)致可能存在不合理風(fēng)險(xiǎn)的WhatsApp%E3%80%90+86%2015855158769%E3%80%91crawl%20crane产品;
- (四)其他需要召回的產(chǎn)品。
- 第五条 医疗器械生产企业是控制与消除产品缺陷的责任主体,应当主动对缺陷产品实施召回。
- 第六条 医疗器械生产企业应当按照本办法的规定建立健全医疗器械召回管理制度,收集医疗器械安全相关信息,对可能的缺陷产品进行调查、评估,及时召回缺陷产品。
- 進(jìn)口醫(yī)療器械的境外制造廠商在中國(guó)境內(nèi)指定的代理人應(yīng)當(dāng)將僅在境外實(shí)施醫(yī)療器械召回的有關(guān)信息及時(shí)報(bào)告國(guó)家食品藥品監(jiān)督管理總局;凡涉及在境內(nèi)實(shí)施召回的,中國(guó)境內(nèi)指定的代理人應(yīng)當(dāng)按照本辦法的規(guī)定組織實(shí)施。
- 醫(yī)療器械經(jīng)營(yíng)企業(yè)、使用單位應(yīng)當(dāng)積極協(xié)助醫(yī)療器械生產(chǎn)企業(yè)對(duì)缺陷產(chǎn)品進(jìn)行調(diào)查、評(píng)估,主動(dòng)配合生產(chǎn)企業(yè)履行召回義務(wù),按照召回計(jì)劃及時(shí)傳達(dá)、反饋醫(yī)療器械召回信息,控制和收回缺陷產(chǎn)品。
- 第七条 医疗器械经营企业、使用单位发现其经营、使用的医疗器械可能为缺陷产品的,应当立即暂停销售或者使用该医疗器械,及时通知医疗器械生产企业或者供货商,并向所在地省、自治区、直辖市食品药品监督管理部门报告;使用单位为医疗机构的,还应当同时向所在地省、自治区、直辖市卫生行政部门报告。
- 醫(yī)療器械經(jīng)營(yíng)企業(yè)、使用單位所在地省、自治區(qū)、直轄市食品藥品監(jiān)督管理部門(mén)收到報(bào)告后,應(yīng)當(dāng)及時(shí)通報(bào)醫(yī)療器械生產(chǎn)企業(yè)所在地省、自治區(qū)、直轄市食品藥品監(jiān)督管理部門(mén)。
- 第八条 召回医疗器械的生产企业所在地省、自治区、直辖市食品药品监督管理部门负责医疗器械召回的监督管理,其他省、自治区、直辖市食品药品监督管理部门应当配合做好本行政区域内医疗器械召回的有关工作。
- 國(guó)家食品藥品監(jiān)督管理總局監(jiān)督全國(guó)醫(yī)療器械召回的管理工作。
- 第九条 国家食品药品监督管理总局和省、自治区、直辖市食品药品监督管理部门应当按照医疗器械召回信息通报和信息公开有关制度,采取有效途径向社会公布缺陷产品信息和召回信息,必要时向同级卫生行政部门通报相关信息。
- 第二章 医疗器械缺陷的调查与评估
- 第十条 医疗器械生产企业应当按照规定建立健全医疗器械质量管理体系和医疗器械不良事件监测系统,收集、记录医疗器械的质量投诉信息和医疗器械不良事件信息,对收集的信息进行分析,对可能存在的缺陷进行调查和评估。
- 醫(yī)療器械經(jīng)營(yíng)企業(yè)、使用單位應(yīng)當(dāng)配合醫(yī)療器械生產(chǎn)企業(yè)對(duì)有關(guān)醫(yī)療器械缺陷進(jìn)行調(diào)查,并提供有關(guān)資料。
- 第十一条 医疗器械生产企业应当按照规定及时将收集的医疗器械不良事件信息向食品药品监督管理部门报告,食品药品监督管理部门可以对医疗器械不良事件或者可能存在的缺陷进行分析和调查,医疗器械生产企业、经营企业、使用单位应当予以配合。
- 第十二条 对存在缺陷的医疗器械产品进行评估的主要内容包括:
- (一)產(chǎn)品是否符合強(qiáng)制性標(biāo)準(zhǔn)、經(jīng)注冊(cè)或者備案的產(chǎn)品技術(shù)要求;
- (二)在使用醫(yī)療器械過(guò)程中是否發(fā)生過(guò)故障或者傷害;
- (三)在現(xiàn)有使用環(huán)境下是否會(huì)造成傷害,是否有科學(xué)文獻(xiàn)、研究、相關(guān)試驗(yàn)或者驗(yàn)證能夠解釋傷害發(fā)生的原因;
- (四)傷害所涉及的地區(qū)范圍和人群特點(diǎn);
- (五)對(duì)人體健康造成的傷害程度;
- (六)傷害發(fā)生的概率;
- (七)發(fā)生傷害的短期和長(zhǎng)期后果;
- (八)其他可能對(duì)人體造成傷害的因素。
- 第十三条 根据医疗器械缺陷的严重程度,医疗器械召回分为:
- (一)一級(jí)召回:使用該醫(yī)療器械可能或者已經(jīng)引起嚴(yán)重健康危害的;
- (二)二級(jí)召回:使用該醫(yī)療器械可能或者已經(jīng)引起暫時(shí)的或者可逆的健康危害的;
- (三)三級(jí)召回:使用該醫(yī)療器械引起危害的可能性較小但仍需要召回的。
- 醫(yī)療器械生產(chǎn)企業(yè)應(yīng)當(dāng)根據(jù)具體情況確定召回級(jí)別并根據(jù)召回級(jí)別與醫(yī)療器械的銷(xiāo)售和使用情況,科學(xué)設(shè)計(jì)召回計(jì)劃并組織實(shí)施。
- 第三章 主动召回
- 第十四条 醫(yī)療器械生產(chǎn)企業(yè)按照本辦法第十条、第十二条的要求進(jìn)行調(diào)查評(píng)估后,確定醫(yī)療器械產(chǎn)品存在缺陷的,應(yīng)當(dāng)立即決定并實(shí)施召回,同時(shí)向社會(huì)發(fā)布產(chǎn)品召回信息。
- 實(shí)施一級(jí)召回的,醫(yī)療器械召回公告應(yīng)當(dāng)在國(guó)家食品藥品監(jiān)督管理總局網(wǎng)站和中央主要媒體上發(fā)布;實(shí)施二級(jí)、三級(jí)召回的,醫(yī)療器械召回公告應(yīng)當(dāng)在省、自治區(qū)、直轄市食品藥品監(jiān)督管理部門(mén)網(wǎng)站發(fā)布,省、自治區(qū)、直轄市食品藥品監(jiān)督管理部門(mén)網(wǎng)站發(fā)布的召回公告應(yīng)當(dāng)與國(guó)家食品藥品監(jiān)督管理總局網(wǎng)站鏈接。
- 第十五条 医疗器械生产企业作出医疗器械召回决定的,一级召回应当在1日内,二级召回应当在3日内,三级召回应当在7日内,通知到有关医疗器械经营企业、使用单位或者告知使用者。
- 召回通知應(yīng)當(dāng)包括以下內(nèi)容:
- (一)召回醫(yī)療器械名稱(chēng)、型號(hào)規(guī)格、批次等基本信息;
- (二)召回的原因;
- (三)召回的要求,如立即暫停銷(xiāo)售和使用該產(chǎn)品、將召回通知轉(zhuǎn)發(fā)到相關(guān)經(jīng)營(yíng)企業(yè)或者使用單位等;
- (四)召回醫(yī)療器械的處理方式。
- 第十六条 医疗器械生产企业作出医疗器械召回决定的,应当立即向所在地省、自治区、直辖市食品药品监督管理部门和批准该产品注册或者办理备案的食品药品监督管理部门提交医疗器械召回事件报告表,并在5个工作日内将调查评估报告和召回计划提交至所在地省、自治区、直辖市食品药品监督管理部门和批准注册或者办理备案的食品药品监督管理部门备案。
- 醫(yī)療器械生產(chǎn)企業(yè)所在地省、自治區(qū)、直轄市食品藥品監(jiān)督管理部門(mén)應(yīng)當(dāng)在收到召回事件報(bào)告表1個(gè)工作日內(nèi)將召回的有關(guān)情況報(bào)告國(guó)家食品藥品監(jiān)督管理總局。
- 第十七条 调查评估报告应当包括以下内容:
- (一)召回醫(yī)療器械的具體情況,包括名稱(chēng)、型號(hào)規(guī)格、批次等基本信息;
- (二)實(shí)施召回的原因;
- (三)調(diào)查評(píng)估結(jié)果;
- (四)召回分級(jí)。
- 召回計(jì)劃應(yīng)當(dāng)包括以下內(nèi)容:
- (一)醫(yī)療器械生產(chǎn)銷(xiāo)售情況及擬召回的數(shù)量;
- (二)召回措施的具體內(nèi)容,包括實(shí)施的組織、范圍和時(shí)限等;
- (三)召回信息的公布途徑與范圍;
- (四)召回的預(yù)期效果;
- (五)醫(yī)療器械召回后的處理措施。
- 第十八条 医疗器械生产企业所在地省、自治区、直辖市食品药品监督管理部门可以对生产企业提交的召回计划进行评估,认为生产企业所采取的措施不能有效消除产品缺陷或者控制产品风险的,应当书面要求其采取提高召回等级、扩大召回范围、缩短召回时间或者改变召回产品的处理方式等更为有效的措施进行处理。医疗器械生产企业应当按照食品药品监督管理部门的要求修改召回计划并组织实施。
- 第十九条 医疗器械生产企业对上报的召回计划进行变更的,应当及时报所在地省、自治区、直辖市食品药品监督管理部门备案。
- 第二十条 医疗器械生产企业在实施召回的过程中,应当根据召回计划定期向所在地省、自治区、直辖市食品药品监督管理部门提交召回计划实施情况报告。
- 第二十一条 医疗器械生产企业对召回医疗器械的处理应当有详细的记录,并向医疗器械生产企业所在地省、自治区、直辖市食品药品监督管理部门报告,记录应当保存至医疗器械注册证失效后5年,第一类医疗器械召回的处理记录应当保存5年。对通过警示、检查、修理、重新标签、修改并完善说明书、软件更新、替换、销毁等方式能够消除产品缺陷的,可以在产品所在地完成上述行为。需要销毁的,应当在食品药品监督管理部门监督下销毁。
- 第二十二条 医疗器械生产企业应当在召回完成后10个工作日内对召回效果进行评估,并向所在地省、自治区、直辖市食品药品监督管理部门提交医疗器械召回总结评估报告。
- 第二十三条 医疗器械生产企业所在地省、自治区、直辖市食品药品监督管理部门应当自收到总结评估报告之日起10个工作日内对报告进行审查,并对召回效果进行评估;认为召回尚未有效消除产品缺陷或者控制产品风险的,应当书面要求生产企业重新召回。医疗器械生产企业应当按照食品药品监督管理部门的要求进行重新召回。
- 第四章 责令召回
- 第二十四条 食品药品监督管理部门经过调查评估,认为医疗器械生产企业应当召回存在缺陷的医疗器械产品而未主动召回的,应当责令医疗器械生产企业召回医疗器械。
- 責(zé)令召回的決定可以由醫(yī)療器械生產(chǎn)企業(yè)所在地省、自治區(qū)、直轄市食品藥品監(jiān)督管理部門(mén)作出,也可以由批準(zhǔn)該醫(yī)療器械注冊(cè)或者辦理備案的食品藥品監(jiān)督管理部門(mén)作出。作出該決定的食品藥品監(jiān)督管理部門(mén),應(yīng)當(dāng)在其網(wǎng)站向社會(huì)公布責(zé)令召回信息。
- 醫(yī)療器械生產(chǎn)企業(yè)應(yīng)當(dāng)按照食品藥品監(jiān)督管理部門(mén)的要求進(jìn)行召回,并按本辦法第十四条第二款的規(guī)定向社會(huì)公布產(chǎn)品召回信息。
- 必要時(shí),食品藥品監(jiān)督管理部門(mén)可以要求醫(yī)療器械生產(chǎn)企業(yè)、經(jīng)營(yíng)企業(yè)和使用單位立即暫停生產(chǎn)、銷(xiāo)售和使用,并告知使用者立即暫停使用該缺陷產(chǎn)品。
- 第二十五条 食品药品监督管理部门作出责令召回决定,应当将责令召回通知书送达医疗器械生产企业,通知书包括以下内容:
- (一)召回醫(yī)療器械的具體情況,包括名稱(chēng)、型號(hào)規(guī)格、批次等基本信息;
- (二)實(shí)施召回的原因;
- (三)調(diào)查評(píng)估結(jié)果;
- (四)召回要求,包括范圍和時(shí)限等。
- 第二十六条 醫(yī)療器械生產(chǎn)企業(yè)收到責(zé)令召回通知書(shū)后,應(yīng)當(dāng)按照本辦法第十五条、第十六条的規(guī)定通知醫(yī)療器械經(jīng)營(yíng)企業(yè)和使用單位或者告知使用者,制定、提交召回計(jì)劃,并組織實(shí)施。
- 第二十七条 醫(yī)療器械生產(chǎn)企業(yè)應(yīng)當(dāng)按照本辦法第十九条、第二十条、第二十一条、第二十二条的規(guī)定向食品藥品監(jiān)督管理部門(mén)報(bào)告醫(yī)療器械召回的相關(guān)情況,進(jìn)行召回醫(yī)療器械的后續(xù)處理。
- 食品藥品監(jiān)督管理部門(mén)應(yīng)當(dāng)按照本辦法第二十三条的規(guī)定對(duì)醫(yī)療器械生產(chǎn)企業(yè)提交的醫(yī)療器械召回總結(jié)評(píng)估報(bào)告進(jìn)行審查,并對(duì)召回效果進(jìn)行評(píng)價(jià),必要時(shí)通報(bào)同級(jí)衛(wèi)生行政部門(mén)。經(jīng)過(guò)審查和評(píng)價(jià),認(rèn)為召回不徹底、尚未有效消除產(chǎn)品缺陷或者控制產(chǎn)品風(fēng)險(xiǎn)的,食品藥品監(jiān)督管理部門(mén)應(yīng)當(dāng)書(shū)面要求醫(yī)療器械生產(chǎn)企業(yè)重新召回。醫(yī)療器械生產(chǎn)企業(yè)應(yīng)當(dāng)按照食品藥品監(jiān)督管理部門(mén)的要求進(jìn)行重新召回。
- 第五章 法律责任
- 第二十八条 医疗器械生产企业因违反法律、法规、规章规定造成上市医疗器械存在缺陷,依法应当给予行政处罚,但该企业已经采取召回措施主动消除或者减轻危害后果的,食品药品监督管理部门依照《中华人民共和国行政处罚法》的规定给予从轻或者减轻处罚;违法行为轻微并及时纠正,没有造成危害后果的,不予处罚。
- 醫(yī)療器械生產(chǎn)企業(yè)召回醫(yī)療器械的,不免除其依法應(yīng)當(dāng)承擔(dān)的其他法律責(zé)任。
- 第二十九条 醫(yī)療器械生產(chǎn)企業(yè)違反本辦法第二十四条規(guī)定,拒絕召回醫(yī)療器械的,依據(jù)《醫(yī)療器械監(jiān)督管理?xiàng)l例》第六十六條的規(guī)定進(jìn)行處理。
- 第三十条 医疗器械生产企业有下列情形之一的,予以警告,责令限期改正,并处3万元以下罚款:
- (一)違反本辦法第十四条規(guī)定,未按照要求及時(shí)向社會(huì)發(fā)布產(chǎn)品召回信息的;
- (二)違反本辦法第十五条規(guī)定,未在規(guī)定時(shí)間內(nèi)將召回醫(yī)療器械的決定通知到醫(yī)療器械經(jīng)營(yíng)企業(yè)、使用單位或者告知使用者的;
- (三)違反本辦法第十八条、第二十三条、第二十七条第二款規(guī)定,未按照食品藥品監(jiān)督管理部門(mén)要求采取改正措施或者重新召回醫(yī)療器械的;
- (四)違反本辦法第二十一条規(guī)定,未對(duì)召回醫(yī)療器械的處理作詳細(xì)記錄或者未向食品藥品監(jiān)督管理部門(mén)報(bào)告的。
- 第三十一条 医疗器械生产企业有下列情形之一的,予以警告,责令限期改正;逾期未改正的,处3万元以下罚款:
- (一)未按照本辦法規(guī)定建立醫(yī)療器械召回管理制度的;
- (二)拒絕配合食品藥品監(jiān)督管理部門(mén)開(kāi)展調(diào)查的;
- (三)未按照本辦法規(guī)定提交醫(yī)療器械召回事件報(bào)告表、調(diào)查評(píng)估報(bào)告和召回計(jì)劃、醫(yī)療器械召回計(jì)劃實(shí)施情況和總結(jié)評(píng)估報(bào)告的;
- (四)變更召回計(jì)劃,未報(bào)食品藥品監(jiān)督管理部門(mén)備案的。
- 第三十二条 醫(yī)療器械經(jīng)營(yíng)企業(yè)、使用單位違反本辦法第七条第一款規(guī)定的,責(zé)令停止銷(xiāo)售、使用存在缺陷的醫(yī)療器械,并處5000元以上3萬(wàn)元以下罰款;造成嚴(yán)重后果的,由原發(fā)證部門(mén)吊銷(xiāo)《醫(yī)療器械經(jīng)營(yíng)許可證》。
- 第三十三条 医疗器械经营企业、使用单位拒绝配合有关医疗器械缺陷调查、拒绝协助医疗器械生产企业召回医疗器械的,予以警告,责令限期改正;逾期拒不改正的,处3万元以下罚款。
- 第三十四条 食品药品监督管理部门及其工作人员不履行医疗器械监督管理职责或者滥用职权、玩忽职守,有下列情形之一的,由监察机关或者任免机关根据情节轻重,对直接负责的主管人员和其他直接责任人员给予批评教育,或者依法给予警告、记过或者记大过的处分;造成严重后果的,给予降级、撤职或者开除的处分:
- (一)未按規(guī)定向社會(huì)發(fā)布召回信息的;
- (二)未按規(guī)定向相關(guān)部門(mén)報(bào)告或者通報(bào)有關(guān)召回信息的;
- (三)應(yīng)當(dāng)責(zé)令召回而未采取責(zé)令召回措施的;
- (四)違反本辦法第二十三条和第二十七条第二款規(guī)定,未能督促醫(yī)療器械生產(chǎn)企業(yè)有效實(shí)施召回的。
- 第六章 附 则
- 第三十五条 召回的医疗器械已经植入人体的,医疗器械生产企业应当与医疗机构和患者共同协商,根据召回的不同原因,提出对患者的处理意见和应当采取的预案措施。
- 第三十六条 召回的医疗器械给患者造成损害的,患者可以向医疗器械生产企业要求赔偿,也可以向医疗器械经营企业、使用单位要求赔偿。患者向医疗器械经营企业、使用单位要求赔偿的,医疗器械经营企业、使用单位赔偿后,有权向负有责任的医疗器械生产企业追偿。
- 第三十七条 本辦法自2017年5月1日起施行。2011年7月1日起施行的《医疗器械召回管理办法(試行)》(中華人民共和國(guó)衛(wèi)生部令第82號(hào))同時(shí)廢止。
責(zé)任編輯:鄭莉莉
迪亚斯:想成英超最佳就不能害怕阿森纳曼城离最佳状态还有很远

平潭尊捷广场室外作业全面启动 西侧正铺贴花岗岩

平潭城区万宝西路南侧山地公园浇筑水泥垫层

平潭中银路道路改造工程 收水口施工已接近尾声

我县启动“品质消费教育乡村行”活动

邮储武平支行加快推进“信用村”建设

小因扎吉:这是一场非常重要的胜利,轮换国米有23名首发球员

黔西南2020年高中最低控制分数线公布

半场莱万梅开二度亚马尔中柱特狮受伤离场巴萨暂21黄潜
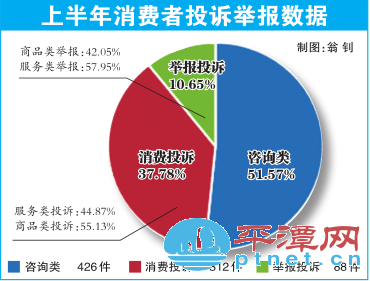
平潭市场监管局:公布上半年消费者投诉举报数据

撒哈拉沙漠小镇艾因塞弗拉遭遇寒流侵袭 骆驼卧沙丘上看雪

国家海洋局副局长房建孟来岚调研海岛开发情况
 激活!拉菲尼亚本赛季7场已为巴萨参与7球,上赛季耗时16场
激活!拉菲尼亚本赛季7场已为巴萨参与7球,上赛季耗时16场激活!拉菲尼亚本赛季7场已为巴萨参与7球,上赛季耗时16场
 平潭秋季幼儿园和初1年剩余学额公布 后天起报名
平潭秋季幼儿园和初1年剩余学额公布 后天起报名平潭秋季幼儿园和初1年剩余学额公布 后天起报名
 平潭6个男子偷电缆 直接剥皮带走红铜
平潭6个男子偷电缆 直接剥皮带走红铜平潭6个男子偷电缆 直接剥皮带走红铜
 儿子没考好 爸爸想反思原因检查书包时翻出手绘版《本草纲目》
儿子没考好 爸爸想反思原因检查书包时翻出手绘版《本草纲目》儿子没考好 爸爸想反思原因检查书包时翻出手绘版《本草纲目》
 亚马尔本赛季已直接参与9球,五大联赛仅次于凯恩&哈兰德
亚马尔本赛季已直接参与9球,五大联赛仅次于凯恩&哈兰德亚马尔本赛季已直接参与9球,五大联赛仅次于凯恩&哈兰德
 平潭召开“2016项目建设年”第1次点评会
平潭召开“2016项目建设年”第1次点评会平潭召开“2016项目建设年”第1次点评会
 平潭“十三五”规划获批 建成两岸共同家园
平潭“十三五”规划获批 建成两岸共同家园平潭“十三五”规划获批 建成两岸共同家园
 龙岩冠豸山机场开通新航线 去昆明、南京更便捷
龙岩冠豸山机场开通新航线 去昆明、南京更便捷龙岩冠豸山机场开通新航线 去昆明、南京更便捷
 一夫当关!格瓦迪奥尔禁区内抽射,拉亚快速下地挡出
一夫当关!格瓦迪奥尔禁区内抽射,拉亚快速下地挡出一夫当关!格瓦迪奥尔禁区内抽射,拉亚快速下地挡出
 国家海洋局副局长房建孟来岚调研海岛开发情况
国家海洋局副局长房建孟来岚调研海岛开发情况国家海洋局副局长房建孟来岚调研海岛开发情况
 台风“尼伯特”来袭 平潭景区全部关闭
台风“尼伯特”来袭 平潭景区全部关闭台风“尼伯特”来袭 平潭景区全部关闭
 龙岩一男子谎称家中办喜事 诈骗大量名贵香烟
龙岩一男子谎称家中办喜事 诈骗大量名贵香烟龙岩一男子谎称家中办喜事 诈骗大量名贵香烟







